21世纪经济报道记者 唐唯珂 鹿思佳 广州报道 国内新冠病毒抗原检测正式走向大众。
3月12日,国家药监局发布通告,批准南京诺唯赞、北京金沃夫、深圳华大因源、广州万孚生物、北京华科泰生物的新冠抗原产品自测应用申请变更。自此这五款新冠抗原自测产品可正式面向普通民众上市销售。
此前3月11日,国家卫健委官网公布了《关于印发新冠病毒抗原检测应用方案(试行)的通知》(以下简称为《通知》)。《通知》表示,国务院决定在核酸检测的基础上,增加抗原检测作为补充。社区居民有自我检测需求的,可通过零售药店、网络销售平台等渠道,自行购买抗原检测试剂进行自测。
这意味着新冠抗原自测模式在国内的正式落地。此前国内新冠病毒检测主要是以核酸检测为主,随着国家批准应用新冠抗原检测,后续相关产品国内注册审批上市速度也会进一步加快,将给体外检测行业带来新的巨大增长点。
此外,国内新冠抗原检测产品在线上线下零售渠道上市销售工作已经启动。
抗原检测为补充 核酸检测仍为金标准
国内常说的核酸检测,全称为聚合酶链式反应(PCR)检测技术,本质上是一种基因扩增技术。也就是,将新冠病毒RNA片段逆转录成双链DNA,再通过DNA聚合酶进行扩增,将携带病毒的基因片段不断放大,然后通过一种荧光探针来捕捉,当扩增后的病毒浓度达到一个临界值时,会有荧光信号提示,意味着样本中存在新冠病毒。
国外所用的家庭自助检测,是一种抗原检测技术。新冠病毒感染人体后,其病毒蛋白可作为抗原,刺激人体细胞产生特异性抗体。抗原检测就是利用病毒抗原和抗体相结合的原理,去检测人们的口鼻分泌物中是否有病毒抗原。
复旦大学附属华山医院感染科主任张文宏此前表示:“抗原就像是病毒外面穿的‘衣服’,核酸就是病毒里面的基因。抗原的检测方法,是从抗体出发去测‘衣服’,综合特异性之后,就可以让病毒显示出来。核酸检测,需要通过扩增来完成,检测敏感性更高,但获得结果所需时间也更长。”

(21世纪经济报道记者根据公开资料整理。核酸价格根据此前2021年底广东省发展改革委、广东省财政厅发布的《关于进一步降低疾控机构新冠病毒核酸检测收费标准的通知》;抗原检测价格根据FDA批准的新冠自检试剂盒售价统计得出)
早前欧洲、美国、日本、印度等都在大力推行家庭自助检测。英国从2020年11月起就开始推广快速抗原检测,居民在网上申请后,检测试剂包邮到家。2022年初,每个美国家庭可以网上预约4次免费试剂盒,在家中完成自我检测。
浙江大学附属邵逸夫医院检验科副主任吴胜军指出,抗原检测的准确性和很多因素有关,比如产品质量、采样准确性。如果不是严格按照说明书来采样操作,对检测结果影响还是比较大的。
此次《通知》认可了核酸检测的重要性,核酸检测依然是新冠病毒感染的确诊依据,抗原检测作为补充手段可以用于特定人群的筛查,有利于提高“早发现”能力。《通知》的下发也意味着国内的新冠检测市场将由核酸检测“一家独大”,过渡到“核酸检测为主,抗原检测为补充”的分级诊断阶段。
关于抗原检测的价格,香港大学医学院教授、病毒学家金冬雁此前在接受采访时分析称,合理区间出厂价大约1人份5元,2人份8-10元,终端售价不超过20元/人份。但他也同样表示:“就目前而言,抗原检测的成本受生产规模、原料来源等因素的影响,目前成本上涨幅度较大,关键原材料供不应求。”
注册审批速度加快
作为新冠防控的有效补充检测方法之一,抗原居家检测有望凭借其便捷、快速等优势迎来市场的快速增长。
3月12日,国家药监局批准北京华科泰生物、南京诺唯赞、北京金沃夫、深圳华大因源、广州万孚生物的新冠抗原产品自测应用申请变更。自此,五款新冠抗原产品正式上市,技术路径覆盖胶体金、乳胶、荧光免疫层析等对仪器环境和操作要求相对简单的多个类型,为《方案》中到基层医疗卫生机构就诊人员开展新冠抗原快速检测提供了可及的选择。
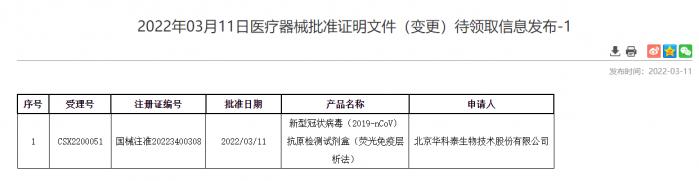
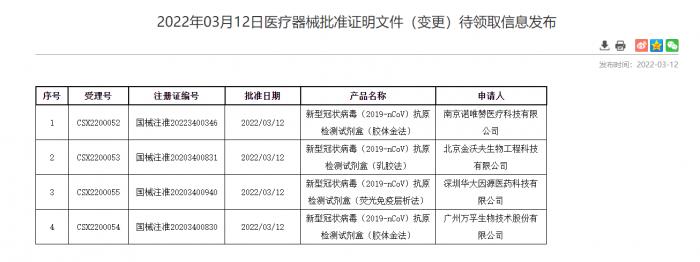
(图:国家药品监督管理局网站)
3月12日午间,央视新闻也报道称,南京诺唯赞、北京金沃夫、华大因源、万孚生物以及北京华科泰累计5款新冠抗原产品均获批,且实现自测应用申请变更。
“此次注册变更的核心在于是否真的不再限定该检测试剂仅由专业技术人员使用。这意味着,注册变更后,检测试剂的使用范围进一步扩大,拥有在零售药店、网络销售平台进行销售的资格。 ”华南某体外检测人士向21世纪经济报道记者表示。
此前有媒体曝出,大参林与万孚生物已经就新冠抗原自测试剂的分销签订战略合作协议,万孚生物新冠抗原自测试剂将“首发”于大参林线下门店。
对此21世纪经济报道记者求证万孚生物方面,其回复到:12日晚间发布于万孚生物公众号的官方声明,其中表示,对于未经公司合法授权、擅自通过电商以及其他线上渠道、宣称可销售我公司研发的新型冠状病毒(2019-nCoV)抗原检测试剂盒(胶体金法)产品的个人及公司,公司保留向相关公安部门报案并追究相应法律责任的权利。
此外,据老百姓大药房集团公众号,12日,老百姓大药房(603883)与广州万孚生物达成合作,第一批新冠抗原快测产品已在物流运输途中,预计近日将在门店上架销售。首批产品将登陆老百姓大药房位于上海、湖南、江苏等12 个省市的门店。据其介绍万孚生物的新冠抗原快测产品15分钟就可以得出检测结果。
据了解,此前国内获批《医疗器械注册证》的企业较少,是因为国内对新冠检测产品的注册审批更加严格。
国家药监局此前提出的抗原检测试剂注册技术审评要点,要求根据前期研究情况确定,入组病例或达到500人。而欧美对新冠抗原自检试剂盒的临床要求,参照了WHO的临时指导文件,包括灵敏度、特异性、阳性符合率、阴性符合率等核心指标,但对临床入组人数没有严格规定。
最新获批上市的5款新冠抗原检测试剂盒产品也说明,随着我国抗原检测的放开,国内注册审批速度也在加快。
市场逐步释放?
在最新获批上市的5家公司中,万孚生物(300482)、深圳华大因源其控股公司华大基因(300676)、诺唯赞(688105)均为A股公司,而北京金沃夫和北京华科泰生物尚未登陆资本市场。
此前,诺唯赞披露了2021年业绩快报。报告显示,去年全年公司实现营业收入18.64亿元,较上年同期增长19.13%,其中新冠相关业务(包括诊断原料及终端检测试剂)的销售收入实现约11.46亿元,占营业收入的比重达61.48%。
据悉,报告期内得益于我国新冠防疫政策,公司常规业务主要客户群体的业务开展在报告期内得以及时回归常态与复苏。公司涵盖科研试剂、测序试剂、诊断原料、诊断试剂及仪器、CRO服务等在内的常规业务实现销售收入7.18亿元,相对2020年度同期增长约92%。
在新冠业务领域,公司主要提供新冠核酸检测的酶原料以及新冠抗体/抗原检测试剂盒。新冠核酸检测酶原料产品主要为公司生物试剂产品中的PCR系列、qPCR系列和逆转录系列。公司抗体/抗原试剂盒以海外出口为主,已取得所需的海外注册准入,结合海外近期疫情反复,预计相关检测试剂的出口仍具有一定的持续性。
华大基因公布的年度业绩快报显示,2020年,华大基因实现营业收入和净利润分别为83.97亿元和21.02亿元,同比增长199.86%和656.43%。其中,来自精准医学检测综合解决方案的收入同比大增8.7倍;感染防控类服务的收入同比大增7.2倍。
万孚生物专业从事快速诊断试剂及配套仪器的研发、制造、营销及服务,其3月8日在投资者互动平台表示,2021年前三季度公司新冠业务实现收入约为8亿元,其中大部分来自于新冠抗原自测产品的海外销售贡献。
除前述首批5家企业外,我国已有多家企业可量产抗原检测试剂盒,但此前相关产品主要用于出口。据海关总署发布,2021年中国累计向海外出口668.93亿元金额的新冠检测试剂盒,2021年12月全国新冠试剂出口单月超100亿元。
1月14日,九安医疗宣布其子公司已与美国ACC签署抗原自测试剂盒采购合同并生效,合同价税合计金额高达12.75亿美元,合81.02亿元人民币。
除了九安医疗,东方生物等公司亦获得了新冠抗原家用自测产品在美国等EUA(紧急使用授权);在欧洲,万孚生物、东方生物、基蛋生物等公司新冠抗原家用自测产品获得CE认证。
中泰证券研究所统计显示,从全球范围来看,目前已有200多家企新冠抗原试剂盒上市销售,其中国产品牌凭借行业领先的检验效果以及生产供应能力迅速占领海外市场,获批数量占半数以上。
随着全球疫情反复,各地对病毒检测需求持续增长,抗原检测市场广阔。以美国为例,根据PolarisMarketResearch数据显示,2020年美国新冠抗原检测市场规模为5.2亿美元,预计2021年市场规模能达到45.6亿美元,2022年达87.0亿美元。
随着政策落地,国内对抗原检测试剂的需求量将大幅增加。中泰证券在研报中指出,参考海外发放政策,随着国内抗原自检试剂盒正式放开,预计国内新冠抗原自检试剂盒市场单月规模有望达177-266亿元,年市场规模将达到2124-3192亿元。
国家药监局网站显示,当前,国内累计有超30款新型冠状病毒2019-nCoV核酸检测试剂盒获批。其中,涉及的上市公司包括明德生物、迈克生物、达安基因、圣湘生物、硕世生物、安图生物、东方生物、之江生物。在前述公司中,不乏盈利能力从千万增长破亿乃至几十亿且近三年业绩持续增长的案例。当前,抗原检测试剂盒目前的获批数量远不如核酸检测试剂盒。
但此前一位体外诊断试剂领域的分析人士认为,由于抗原检测试剂的技术门槛不高,这些厂商可能会很快推出自己的抗原检测产品。并且未来这些产品的采购量如何,疫情防控政策是否会有更新的规定,以及实际规定运用的检验检测场景都会影响相关公司业绩。
广州医科大学附属市八医院感染病中心首席专家蔡卫平则表示,已经在国外市场获得肯定的企业会占据一定优势。原因在于,其通过的欧盟及美国食品药品监督管理局(FDA)应急使用许可含金量较高,也有现成的海外临床试验数据可用,部分材料可以直接用以国内申请,预计这部分厂商会积极争取国内上市的机会。


















 粤公网安备 44010402000579号
粤公网安备 44010402000579号